1. Diketahui:
Cu2+ +
2e– →
Cu
E° = 0,34 Volt
Mg2+ +
2e– → Mg
E° =
-2,34 Volt
Potensial
reaksi berikut adalah…
Cu
+ Mg2+ → Cu2+ + Mg
a.
+3,12 Volt
b.
-3,12 Volt
c.
+2,68 Volt
d.
-2,68 Volt
e.
-0,13 Volt
Jawaban:
C
Pembahasan:
E°sel = E°reduksi – E°oksidasi
E°sel = EOCu – EOMg
E°sel = (0,34 – (-2,34)) volt
E°sel = 2,68 Volt
2. Reaksi yang terjadi pada anode dari
sel kering (sel leclanche) adalah.......

Jawaban: B
Pembahasan:
Sel
leclanche terdiri atas suatu silinder zink yang berisi pasta dari
campuran batu kawi (MnO2), salmiak (NH4Cl), karbon (C),
dan sedikit air (jadi sel ini tidak 100% kering).
Zink
berfungsi sebagai anode, sedangkan sebagai katode digunakan electrode
inert,yaitu grafit, yang dicelupkan ditengah-tengah pasta. Pasta itu sendiri
berfungsi sebagai oksidator.
Reaksi redoks berikut berlangsung spontan. Fe + Cu2+→ Fe2+ + Cu Gambarlah rangkaian sel volta dan tuliskan notasi sel berdasarkan reaksi tersebut.
3. Pada elektrolisis
seperti gambar di bawah ini persamaan yang menunjukkan reaksi pada elektroda X
adalah …

a. 2H2O (l) → 2H+ (aq) + ½ O2 (g) +
2e–
b. Cu2+(aq) + 2e– → Cu (s)
c. Cu (s) → Cu2+(aq) + 2e–
d. 2H2O (l) + 2e– → H2 (g) +
2OH-(aq)
e. 2H2O (l) → O2 (g) +
4e– + 4OH-(aq)
Jawaban: C
Pembahasan:
Pada sel Elektrolisis :
Katoda (-) tempat terjadinya reaksi reduksi
Anoda
(+) tempat terjadinya reaksi oksidasi
Reaksi
elektrolisis larutan CuSO4 :
Katoda
: ion Cu2+ lebih mudah direduksi daripada H2O
Cu2+
+ 2e → Cu
Anoda
: Cu lebih mudah mengalami oksidasi daripada H2O dan ion SO42- (sisa
asam oksi)
Cu
→ Cu2+ + 2e
Elektroda X adalah kutub positif (anoda)
4.
Dalam elektrolisis larutan CuSO4 dengan elektroda inert
dihasilkan 224 mL gas (STP) di anoda. Massa endapan yang didapat di katoda
adalah ....(Ar Cu = 63,5).
A. 6,35 gram
B. 1,27 gram
C. 0,64 gram
D. 0,32 gram
E. 0,127 gram
Jawaban: B
Pembahasan:
Reaksi
yang terjadi,
Katoda
: Cu2+(aq) + e → Cu(s)
Anoda
: 2H2O(l) → 4H+(aq) + O2(l) + 4e
Volum
gas yang dimaksud adalah gas oksigen (satu-satunya gas yang ada di reaksi),
dimana volumenya 224 mL STP) = 0,224 L
Jumlah mol gas O2 = volume/Vm
= (0,224 L )/(22,4 L/mol)
= 0,01 mol O2
Mol elektron (anoda) = 4 x mol O2 (perbandingan koefisien)
= 0,04 mol
Karena
mol elektron baik di anoda dan katoda sama, maka mol elektron (katoda) =
0,04 mol
Maka, mol logam Cu = 1/2 x 0,04 mol
= 0,02 mol
Massa logam Cu = mol Cu x Ar Cu
= 0,02 x 63,5
= 1,27 gram
5. Bahan yang digunakan sebagai elektrode pada sel aki (accu) adalah …
a. Pt dan C
b. Zn dan C
c. Pb dan PbO2
d. Zn dan Cu
e. Cu dan PbO2
Jawaban : C
Pembahasan:
Aki temasuk sel sekunder, karena selain menghasilkan arus listrik, aki juga dapat diisi arus listrik kembali. Sesuai prinsip pada sel Volta, aki merupakan sel yang terdiri dari elektrode Pb sebagai anode dan PbO2 sebagai katode dengan elektrolit H2SO4.
6. Diketahui:
Potensial
sel yang dihasilkan dari pasangan elektrode Cd dengan Ag adalah …
a.
0,40 V
b.
0,44 V
c.
0,76 V
d.
0,80 V
e.
1,20 V
Jawaban : E
Pembahasan:
Logam yang memiliki E° lebih kecil selalu merupakan
anode (mengalami oksidasi) berarti yang sebagai anode Cd dan sebagai katode Ag.
Notasi Selnya :
Cd|Cd2+||Ag+|Ag
E°sel = E°katode –
E°anode
= + 0,80 – (-0,40)
= 1,20 V
a. Pb dan PbO2 berubah
menjadi Pb3O4
b. Pb dan PbO2 berubah
menjadi PbSO4
c. Pb menjadi PbO2 dan PbO2 menjadi PbSO4
d. Pb menjadi PbO dan PbO2 menjadi Pb3O4
e. Pb menjadi PbSO4 dan PbO2 tetap
Jawaban: B
Pembahasan:
Aki merupakan salah satu aplikasi dari sel volta. Sel aki terdiri dari Pb sebagai anode dan PbO2 sebagai katode dan terdapat larutan elektrolit H2SO4. Sehingga pada anode terjadi terjadi reaksi oksidasi dan pada katode terjadi reaksi reduksi. Sehingga pada saat sel menghasilkan arus listrik, reaksi yang terjadi adalah

Pb mengalami oksidasi menjadi PbO2 jika dilihat dari perubahan biloks Pb yang mempunyai biloks 0 berubah menjadi +2. Didalam PbO dan PbO2 mengalami reduksi menjadi PbSO4 jika dilihat dari perubahan biloks, biloks Pb didalam PbO2 adalah +4 berubah menjadi +2 didala PbSO4 .
8. Diketahui data Eo Zn = – 0,76 volt dapat dikatakan baha dalam keadaan standar …
a.
reaksi Zn2+ + 2e– → Zn selalu tidak spontan
b.
ion Zn 2+ adalah oksidator kuat
c.
ion H+ lebih mudah tereduksi daripada ion Zn 2+
d.
Zn mempunyai kecenderungan lebih besar untuk larut sebagai ion Zn2+
e.
H adalah reduktor yang lebih kuat daripada Zn
Jawaban: C
Pembahasan:
Nilai Potensial Zn = -0,76 volt adalah nilai potensial reduksi ion Zn 2+ + 2e– → Zn. Berdasarkan letak logam Zn didalam deret volta, logam Zn terletak sebelum atau disebelah kiri H. Logam yang berada disebelah kiri H akan sukar tereduksi, serta memiliki nilai potensial negatif.
9. Pada elektrolisis larutan CaCl2 dengan elektroda karbon, di ruang katoda terjadi reaksi....
a. 2Cl− (aq) → Cl2 (g) + 2e
b. 2e + Ca2+ (aq) → Ca (s)
c. 2H2O (l) + 2e → 2OH− (aq)
+ H2 (g)
d. 2Ca (s) → Ca2+ (aq) + 2e
e. 2H2O (l) → 4H+ (aq) + O2
(g) + 4e
Jawaban:
C
Pembahasan:
CaCl2
→ Ca2+ + 2Cl−
Pada
katode terjadi reduksi. ion Ca2+ yang berasal dari logam alkali tanah
tidak tereduksi, sebagai gantinya air yang tereduksi.
2H2O + 2e → 2OH− + H2
10. Notasi sel yang benar sesuai gambar di berikut adalah ….


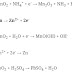
Tidak ada komentar:
Posting Komentar